El estudio de los átomos y todas las partículas que forman parte de este han sido de gran interés para ciencias como la física o la química. Se han desarrollado muchos métodos, que a pesar de parecer simplemente teóricos, facilitan las investigaciones en estas áreas. Es así como surge el principio de Aufbau, el cual enfoca sus procedimientos en torno a los electrones.
Este postulado declara que es posible predecir de manera teórica la configuración electrónica que posee un elemento de la tabla periódica. Aunque fue un esquema propuesto por el físico Niels Bohr, recibió el nombre de Aufbau, proveniente del alemán Aufbauprinzip, que significa principio de construcción. Y es que para aplicar este teorema, se trata de crear una tabla representando las capas de un átomo y los electrones que este contiene.
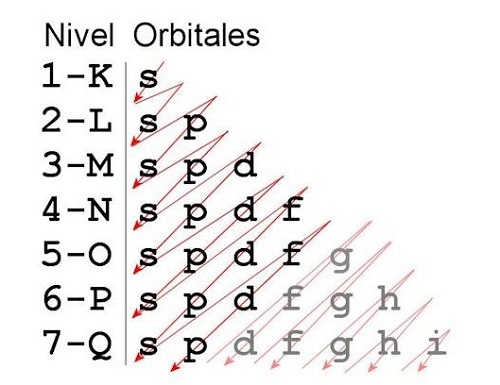
Según lo que se estable en el principio, la idea es construir lo que sería el átomo. Y este se va representando a través de capas y subcapas. Pero para lograrlo, es necesario que su aplicación también sea apoyada en otros dos postulados: el principio de exclusión de Pauli y la regla de Hund.
¿Qué es el principio de Aufbau?
El principio de Aufbau se basa en la teoría de la configuración electrónica. A través de este se declara que a medida que se van incorporando los electrones al núcleo del átomo, lo mismo sucederá con los electrones de manera que se pueda mantener un equilibrio en la carga del elemento. De esta manera, se establecen ciertas normas para poder ubicarlos en los orbitales del átomo. Este principio también ha sido conocido bajo el nombre de regla del serrucho o de Madelung.
Se debe tener en cuenta que durante todo este proceso, se puede comparar a un átomo como una cebolla, la cual posee muchas capas. Y dentro de estas se encuentran las subcapas. Antes de empezar el llenado de los orbitales, hay que tener conocimiento de dos teorías: la regla de Hund y el principio de exclusión de Pauli. Estos ayudan a establecer las reglas de llenado.
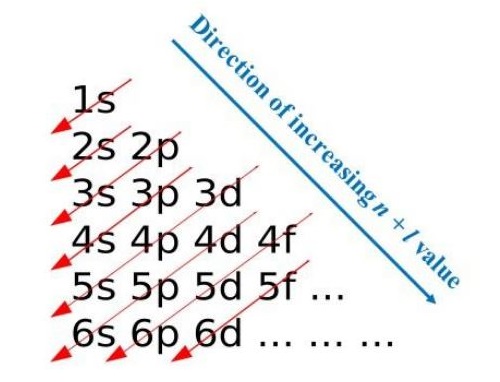
El orden en que se irán colocando cada uno de los electrones, será de manera creciente. Y para las subcapas, los electrones serán ubicados tomando en cuenta el menor valor energía. Tras armar la tabla, se trazan líneas en sentido diagonal, que definen la configuración electrónica del átomo.
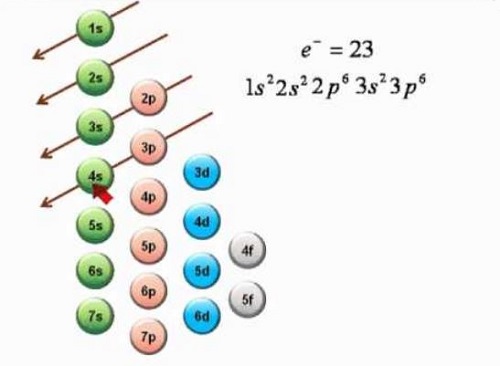
Descubrimiento del principio de Aufbau
Cuando se menciona el método Aufbau, su nombre destaca por ser de procedencia alemana. Y es que su origen viene de Aufbauprinzi, que al ser traducido al español significa principio de construcción. Sin embargo, su desarrollo estuvo en manos de un físico danés, Niels Bohr, quien buscaba indagar acerca de la naturaleza de los átomos y sus características. Aun así, nunca llevo su nombre este postulado.
Bohr busco perfeccionar los aportes de Ernest Rutheford. A partir de esto, estableció ciertas premisas. Destacó que el núcleo del átomo permanece en el centro rodeado por los electrones. Estos a su vez van cambiando de niveles debido a la pérdida o aumento de energía. También se tenía en cuenta que para que ocurriera un salto de nivel, se debía cumplir la ecuación 2n2. Esto se traduce en que el número máximo de electrones que se encuentran ubicados en una órbita será igual al doble del cuadrado del número de la órbita.
Posteriormente, se determinó que cada electrón posee cuatro números cuánticos. El principal es n, definiendo la distancia del núcleo. El segundo es azimutal l, que determina el orbital en que se ubica. Un número magnético m, que identifica la trayectoria a través del orbital. Y por último, un número spin s, pudiendo ser positivo o negativo, y que posee un valor de ½.
Teniendo en cuenta todos estos enunciados, es que se pudo establecer que en el momento que dos electrones cuentan con la misma trayectoria, estos no poseen el mismo número magnético ni número spin. Como conclusión, se dedujo que es posible que dos electrones compartan un mismo nivel orbital. Pero a su vez, los niveles energéticos se encuentran divididos en subniveles, teniendo cada uno sus propios orbitales. Estos solo son capaces de poseer en su estructura tan solo un par de electrones.
Relación del principio de exclusión de Pauli y regla de Hund con el principio de Aufbau
Para la aplicación del principio de Aufbau, es necesario tomar en cuenta otras teorías. Parrtiendo del método de exclusión de Pauli, es que se determinan las subcapas de los orbitales. También existe un enunciado dentro de este principio, que permite entender mejor la configuración del átomo. Ningún electrón posee los mismos números cuánticos que otro. En este caso, no es posible dos electrones estén configurados con los mismos espines negativos o positivos.
El número cuántico spin debe ser diferente para más de un electrón. Y cuando se encuentran en el mismo orbital, estos deben aparearse sus espines. Toda esta teoría es llevada a la práctica mediante la regla de Hund. Se establece entonces que los orbitales se irán llenando según las instrucciones de este método.
En primer lugar, se rige bajo el hecho de que ningún orbital cuenta dos direcciones de giro a menos que los números cuánticos magnéticos de la misma subcapa. Estos deben tener un mínimo de uno. A partir de aquí, se inicia por aquel que tenga el nivel de energía menor. Se parte desde el orbital 1s, y como máximo debe contener dos electrones. Todo esto se realiza tomando en cuenta el número cuántico l. El siguiente será el orbital 2s, y también con un máximo de dos electrones.
Se pasa a la subcapa 2p, ya cual se divide en tres orbitales. Estos permiten un máximo de seis electrones, colocando dos en cada orbital. Pero para que alguno llegue a ese máximo de electrones, es necesario que todos tengan por lo menos uno. Así sucesivamente se irá llenando la tabla para poder comprender la configuración electrónica de un átomo.

Limitaciones del principio de Aufbau
En el caso de metales de transición y elementos como los lantánidos y actínidos, el principio de Aufbau no resulta adecuado para conocer su configuración electrónica. La razón de que esto ocurra es que los orbitales ns y (n-1)d poseen diferencias energéticas bajas.
Este caso ha sido explicado a través de la mecánica cuántica, la cual declara que posiblemente la manera en que reaccionan los electrones es degenerando los orbitales (n-1)d, mientras que desalojan los electrones que se encuentran en los orbitales ns.